Beschleunigung der Entwicklung von Nrg1-Protein-Ersatztherapien – Ein direkter Vergleich mit einer hochgradig verwandten Substanz, welche derzeit in der klinischen Phase III getestet wird.
Wissenschaftlicher Hintergrund
In vorangegangenen Arbeiten haben wir ein multifaktorielles Modell für die NF2-assoziierte Bildung aus Schwann-Zellen abgeleiteten Nervenscheidentumoren (ScNST) identifiziert, welches sowohl Nerven- als auch Gliazellen (Schwann-Zellen) sowie Signale aus der Mikroumgebung des Nervs einbezieht, z. B. die Expression von Oberflächenmolekülen, mechanische Reizung/Verletzung und Immunmodulation (Schulz et al., 2013, 2014; 2016). Konkret haben wir sowohl bei NF2-Patienten als auch in unseren etablierten und krankheitsrelevanten Mausmodellen festgestellt, dass eine reduzierte NF2-Gendosis in Neuronen zu einer Reduktion von axonalem, membrangebundenen Neuregulin 1 beta Typ III (NRG1β3) führt. NRG1β3 ist ein entscheidender Regulator von Schwann-Zellen, der erforderlich ist, um Schwann-Zellen nach Abschluss der Nerven-Regeneration und Reinnervation infolge einer Verletzung wieder zur Differenzierung zu veranlassen. In unserem NF2-Mausmodell führt das Fehlen des von den Axonen stammenden NRG1β3-Differenzierungssignals zu einer anhaltenden Regenerationsreaktion der Schwann-Zellen nach einer Verletzung und fördert so die Entwicklung von patienten-ähnlichen Schwannomen. Injektion von rekombinantem humanem NRG1β (rhNRG1β) hingegen hemmt die Schwannombildung signifikant und verbessert die Nervenregeneration durch eine Induktion der Schwannzelldifferenzierung (Manuskript in Vorbereitung). Die Behandlung mit rhNRG1β stellt daher eine vielversprechende neue Therapiemöglichkeit zur Behandlung von NF2-assoziierten ScNST dar, weil sich insbesondere rhNRG1β in Studien zur chronischer Herzinsuffizienz bereits als allgemein sicher für Anwendung am Menschen erwiesen hat (Mendes-Ferreira et al., 2013).
Derzeit validieren wir die Daten aus unserer Pilotstudie in einer präklinischen, multizentrischen Validierungsstudie, welche nach humanklinischen Standards durchgeführt wird, einschließlich Randomisierung, Verblindung und unabhängiger Analyse durch klinische Biostatistiker sowie Rregist.
In dem Bestreben, die Entwicklung und Umsetzung unserer vorgeschlagenen Proteinersatztherapie vom Labor in die Klinik zu beschleunigen, prüfen wir beständig mit potenziellen Partnern der Industrie Möglichkeiten einer gemeinsamen Entwicklung und synergistischen Umwidmung verwandter Arzneimittelkandidaten. Infolgedessen sind wir kürzlich eine Partnerschaft mit einem Industriepartner eingegangen und haben hierdurch Zugriff auf dessen proprietäres Nrg1-Peptidfragment erhalten (nachfolgend als NeuNRG1 bezeichnet). NeuNRG1 wird derzeit in klinischen Phase-III-Studien zur chronischen Herzinsuffizienz getestet und ist mit dem rhNRG1β-Peptid (RKQ02297 von Reprokine) hochverwandt, welches wir sowohl in unserer Pilot- als auch in unserer präklinischen Studie verwenden. Allerdings existieren einige wenige Aminosäureänderungen im C-Terminus der jeweiligen Peptide, welche potentiell unterschiedliche Wirkungen auf das Schwannomwachstum in vivo haben könnten – oder auch nicht. Zusätzliche Vorsicht ist geboten, da in vivo ebenfalls mehrere verschiedene physiologische Peptide aus Volllängen-Nrg1 erzeugt werden, z. B. durch alternative Spaltung durch verschiedene Proteasen, von denen einige eine pro-differenzierende Wirkung haben, während andere eher pro-proliferative Wirkungen zeigen und damit möglicherweise das Tumorwachstum sogar steigern könnten, anstatt es zu hemmen.
Um diese Frage zu klären und die Verwendbarkeit und das Potenzial von NeuNRG1 für eine beschleunigte Entwicklung einer Proteinersatztherapie für NF2-assoziierte ScNST zu erforschen, planen wir daher einen direkten Vergleich von rhNRG1β von Reprokine (im Folgenden als ReproNRG1 bezeichnet) und NeuNRG1 in unserem etablierten präklinischen Studienframework und Analyse-Pipeline, jedoch in einem angepassten monozentrischen Proof-of-Principle-Studiendesign.
Zielsetzung und Arbeitsziele
Wir werden in unserem etablierten NF2-Mausmodell (Nf2flox/flox;P0-cre;Nefh-Cre) eine Kopf-an-Kopf-Studie über die Auswirkungen einer Behandlung mit ReproNRG1, NeuNRG1 oder einer Placebo-Kontrolle (Vehikel) auf das Schwannomwachstum nach Verletzung des Ischiasnervs in unserem etablierten NF2-Mausmodell durchführen.
Das Hauptziel dieser Kopf-an-Kopf-Studie besteht darin, zu prüfen, ob NeuNRG1 ähnliche Wirkungen wie ReproNRG1 zeigt und somit die weitere gemeinsame Entwicklung einer NRG1-Proteinersatztherapie auf Grundlage der fortgeschrittenen Wissensbasis von NeuNRG1 rechtfertigt. Das sekundäre Ziel dieser Studie ist ein Vergleich der Applikationswege und der Behandlungsdosis, da NeuNRG1 von unserem Industriepartner routinemäßig in Form von (klinisch leichter zugänglichen) subkutanen (s. c.) Injektionen zu 20 mg/kg verwendet wird – im Gegensatz zu intraperitonealen (i. p.) Injektionen zu 10 mg/kg, welche in unseren früheren und laufenden Studien verwendet werden.
Studiendesign
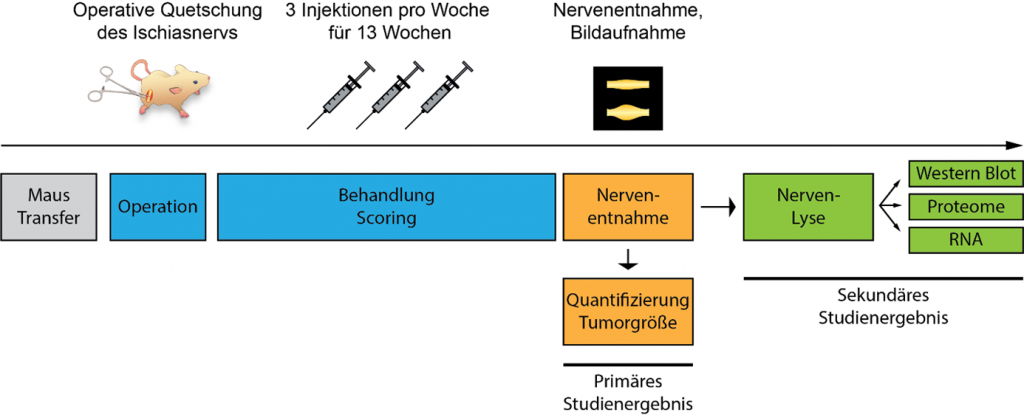
Die Wirksamkeit der Behandlung wird untersucht, indem die Größe des Ischiasnerv(tumors) (Primäres Studienergebnis) 13 Wochen nach Behandlung, beginnend 2 Tage nach der Nervenquetschung, gemessen wird. In einer anschließenden Analyse des Sekundären Studienergebnisses werden die Auswirkungen der Behandlung auf die zelluläre Zusammensetzung und den Differenzierungszustand mittels Proteom- und Phospho-Proteom-Analyse weiter umfassend untersucht. Ein Überblick des Studiendesigns ist in Abbildung 1 zu finden.
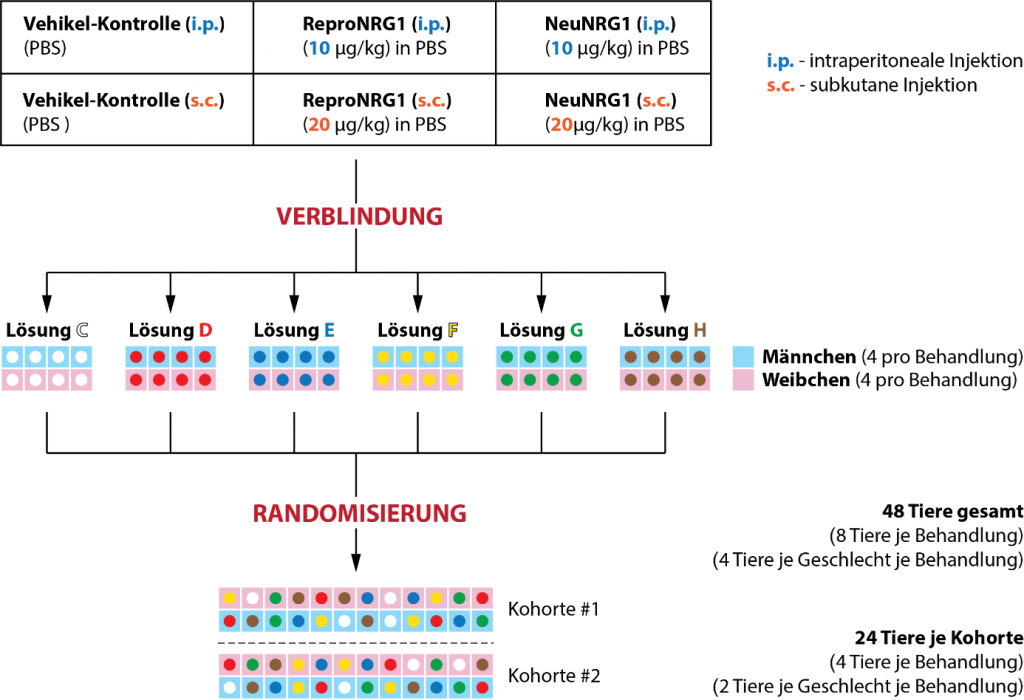
Eine Gesamtzahl von 48 Mäusen wird randomisiert und auf die 6 Behandlungsgruppen verteilt (3 Lösungen mittels 2 Applikationswegen). Die Behandlungsgruppen werden verblindet und farblich als „Lösung C“ bis „Lösung H“ gekennzeichnet. Aus logistischen Gründen werden wir eine Blockrandomisierung durchführen, um die Mäuse auf zwei Kohorten von jeweils 24 Mäusen zu verteilen, die hinsichtlich Geschlecht und Behandlung ausgeglichen sind.
Für Details siehe Abbildung 2.
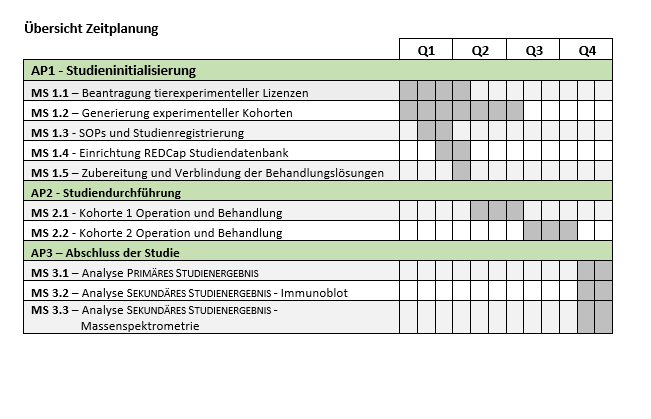
Planung von Arbeitspaketen (AP) und Meilensteinen (MS)
AP1 – Studieninitialisierung
Die Studieninitialisierung umfasst die Antragserstellung und -einreichung für die benötigten Tierversuchsgenehmigungen (MS 1.1), die Generierung und genetische Charakterisierung der Versuchskohorten (MS 1.2), die Anpassung der Standardarbeitsanweisungen (SOPs), welche aus unserem präklinischen, multizentrischen Framework abgeleitet sind, und die anschließende Registrierung der Studie beim Tierversuchsregister des Deutschen Zentrums für den Schutz von Versuchstieren (Bf3R) (MS 1.3), die Einrichtung der REDCap-Studiendatenbank (MS 1.4) und die Vorbereitung der verblindeten Behandlungslösung (MS 1.5).
AP2 – Studiendurchführung
Die Durchführung der Studie umfasst eine definierte, chirurgische Induktion der Tumorbildung durch einseitige Ischiasnervenquetschung, gefolgt von einer 13-wöchigen Behandlung und der anschließenden Isolierung des Ischiasnervs und Bildausnahme, wie in Abbildung 1 und Abbildung 2 dargestellt. Sowohl der verletzte als auch der intakte Nerv jeder Maus werden zum Vergleich und als Referenz isoliert. Aus logistischen Gründen und aufgrund der Anzahl der untersuchten Tiere werden zwei aufeinander folgende Versuchskohorten untersucht (MS 2.1 bzw. MS 2.2; siehe Abbildung 2).
AP3 – Abschluss der Studie
Der Abschluss der Studie umfasst die Analyse des Primären und Sekundären Studienergebnis sowie die biostatistische Analyse. Die Analyse des Primären und Sekundären Studienergebnisses als Größe des Ischiasnervs (Tumor) wird in standardisierter Weise durch halbautomatische Analyse mit Hilfe eines benutzergeführten ImageJ-Makros durchgeführt, welches von uns speziell für diesen Zweck entwickelt und zuvor für die präklinische, multizentrische Studie sowie die Re-Analyse der zugrunde liegenden Pilotdaten verwendet wurde. Als Primäres Studienergebnis werden der maximale Nervendurchmesser (als historischer Parameter in Übereinstimmung mit den Pilotdaten) sowie die mittlere lokale Dicke (als robusteres, reproduzierbareres und repräsentatives Maß für die Gesamtgröße und Form des Nervs) gemessen. Die Primären Studienergebnisse werden – weiterhin verblindet – biostatistisch auf signifikante Behandlungseffekte analysiert, stratifiziert nach Substanz und Verabreichungsweg (MS 3.1).
Für die Analyse des Sekundären Studienergebnisses werden Nervenlysate mittels Immunoblot auf die Expression des Myelin-Basische Proteins (MBP) und des ErbB2-Rezeptors untersucht (MS 3.2, als zwei wichtige Parameter übereinstimmend mit unserer Pilotstudie) sowie mittels Massenspektrometrie das Gesamtproteom und Phospho-Proteoms untersucht (MS 3.3), um die Behandlungseffekte sowohl auf verletzte als auch auf intakte Nerven in einem globalen, unvoreingenommenen Analyseansatz weiter zu bewerten. Weiterhin wird aus den Nervenlysaten RNA isoliert und für mögliche Folgeuntersuchungen und Validierungen mittels RT-qPCR- und/oder RNA-seq-Analysen aufbewahrt, welche jedoch nicht in den Rahmen des vorliegenden Arbeitsprogramms fallen.
Übersicht Zeitplanung
Budgetplanung
Die vorgeschlagenen Arbeiten werden in unser etabliertes präklinisches Studienframework integriert, und wir werden die wissenschaftliche Infrastruktur und Expertise für dieses Projekt zur Verfügung stellen, einschließlich eines dedizierten Projekt-(Meta-)Datenmanagementsystems, eines unabhängigen Studienmonitorings sowie Randomisierungs- und Verblindungsmaßnahmen (welche von einem zusätzlichen gruppeninternen präklinischen Studienmonitor durchgeführt werden, dessen Finanzierung in diesem Antrag nicht beantragt wird).
Um die vorgeschlagenen Arbeiten effizient und zeitnah durchführen zu können, ist es außerdem erforderlich, dass zwei erfahrene Wissenschaftler als Team zusammenarbeiten, insbesondere bei den Operationen und der Behandlung der Tiere. In der verbleibenden Zeit werden die Aufgaben je nach Bedarf innerhalb des Teams verteilt, um den Projektfortschritt zu beschleunigen.

