Entwicklung eines neuartigen, patienten-abgeleiteten Xenotransplantatmodells (PDX) für Neurofibromatose Typ II
Wissenschaftlicher Hintergrund
Die effektive Entwicklung und präklinische Validierung potenzieller therapeutischer Ansätze ist stark abhängig von geeigneten zellulären und organismischen Modellsystemen, welche – je nach untersuchtem Mechanismus oder Effekt – von gereinigten In-vitro-Systemen über stabile oder primäre Zelllinien bis hin zu In-vivo-Modellen reichen können. Mit Blick auf menschliche Patienten erscheint die Verwendung menschlicher Zellen wünschenswert, beschränkt sich aber häufig entweder auf Reinkulturen oder bestenfalls auf definierte Co-Kultursysteme und Organ-on-a-Chip-Setups, die eine In-vivo-Situation, z. B. im Hinblick auf systemische Behandlungsansätze, nicht umfassend widerspiegeln können. Stattdessen stützen sich In-vivo-Modellsysteme häufig auf geeignete transgene Tiermodelle und die Hoffnung einer späteren Übertragbarkeit von der Maus auf den Menschen, was mitunter eine Herausforderung darstellt, vor allem dann, wenn für den Therapieansatz spezifische Eigenschaften der Spezies anvisiert werden müssen (z. B. spezies-spezifische therapeutische blockierende Antikörper, Gen-Editierungs-Ansätze usw.). Eine wirksame Möglichkeit, dies zu berücksichtigen und menschliche Zellen in einem systemischen In-vivo-Modellsystem zu verwenden, sind von Patienten abstammende Xenotransplantat-Modelle (PDX), bei denen menschliche, von Patienten abstammende Zellen in Mäuse eingebracht werden, um menschliche Zielzellen und eine systemische In-vivo-Testumgebung zu kombinieren.
Bisherige Versuche, PDX-Mausmodelle für NF2 zu etablieren, waren jedoch leider nur bedingt erfolgreich. Wurden in der Vergangenheit entweder ganze Stücke menschlicher Schwannom-Proben oder isolierte mutierte Schwann-Zellen in immungeschwächte Mäuse transplantiert, wuchs der Tumor in den meisten Fällen nicht oder verringerte sich mit der Zeit sogar. In den wenigen Fällen, in denen ein In-vivo-Tumorwachstum beobachtet werden konnte, trat dieses erst nach langer Zeit auf und blieb bestenfalls langsam (Lee et al., 1992; Charabi et al., 1994; Stidham et al., 1997; Chang et al., 2006). Darüber hinaus gibt es anekdotische Hinweise aus der Wissenschaft, dass die Immortalisierung menschlicher, aus Tumoren stammender Schwann-Zellen im Vorfeld der Transplantation den Erfolg oder die Tumorwachstumsrate ebenfalls nicht wesentlich verbessert hat.
Bemerkenswerterweise erinnert dieser Phänotyp an frühere Arbeiten an transgenen NF2-Mausmodellen, welche Faktoren des Mikromillieus noch nicht in vollem Umfang berücksichtigten, wie z. B. den Nf2 Mutationsstatus in Neuronen (der sich auf die Expressions axonaler Oberflächenmarkern auswirkt) oder regenerationsauslösende Signale wie Nervenverletzungen. Wie unsere Arbeiten jedoch kürzlich zeigten, sind dies wichtige Beiträge zu einem multifaktoriellen Modell der Schwannombildung (Schulz et al., 2013,2014; 2016): Die homozygote Deletion von NF2 ausschließlich in Schwann-Zellen ohne jede weitere Beeinträchtigung führte dazu, dass nur 25 % der Tiere Tumore entwickelten, und dies auch nur im hohen Alter (24 Monate). Im Gegensatz dazu führte ein zusätzlicher Verlust von NF2 in Neuronen, gefolgt von einer Nervenverletzung dazu, dass 92 % der Mäuse Tumore entwickelten und dies bereits in jungem Alter (Schulz et al., 2016), wobei die Tumorbildung bereits 3 Wochen nach der Verletzung begann.
Dies wirft die Frage auf, ob frühere Versuche, ein NF2-PDX-Mausmodell zu generieren, möglicherweise unter dem Fehlen einer Verletzung/eines regenerationsfördernden Stimulus gelitten haben und somit die Bedeutung der Mikroumgebung des Nervs nicht vollständig berücksichtigt wurde. Studien zu PDX-Modellen für Neurofibromatose Typ 1 (NF1) unterstützen diese Sichtweise und zeigen, wie wichtig die Mikroumgebung der Nerven ist: Während NF1-defiziente Schwann-Zellen (von Patienten stammende oder stabile Zelllinien) kein signifikantes Wachstum zeigten, wenn sie subkutan oder sogar ektopisch auf Ischiasnerven von Tieren transplantiert wurden, führte die Injektion dieser Zellen direkt in die Nerven (was wahrscheinlich zu einer Mikroverletzung führte und die Zellen in der richtigen Mikroumgebung platzierte) zu einem signifikanten und zuverlässigen Tumorwachstum kurz nach der Transplantation (Muir et al., 2001; Perrin et al., 2007; Liao et al., 2016).
Insgesamt stellt sich hieraus die Notwendigkeit dar, ein neues NF2-PDX-Mausmodell zu entwickeln, welches auch die Auswirkungen der Mikroumgebung der Nerven berücksichtigt, um die bei menschlichen Patienten beobachteten Prozesse der Tumorbildung und -progression besser widerzuspiegeln.
Zielsetzung und Arbeitsziele
Die Entwicklung eines neuen NF2-PDX-Mausmodells folgt einem schrittweisen Arbeitsprogramm (s. u.), um die Machbarkeit eines derartigen NF2-PDX-Mausmodells systematisch abzuklären und seine Schlüsselfaktoren zu definieren. Hauptziel ist es, ein robustes und einfach zu verwendendes PDX-Mausmodell zu entwickeln und zu validieren, welches Wissenschaftlern zur Verfügung gestellt und an Industriepartner lizenziert werden kann, um das Screening neuartiger NF2-Therapieansätze zu ermöglichen und zu unterstützen.
Planung von Arbeitspaketen (AP) und Meilensteinen (MS)
AP1 – Allotransplantation von primären Schwann-Zellen der Maus in NF2-Mausmodelle
Im Rahmen dieses Arbeitspakets werden wir die allgemeine Durchführbarkeit einer Transplantation (primärer muriner) Schwann-Zellen in murine Ischiasnerven testen und die zelluläre und genetische Zusammensetzung der Nervenmikroumgebung definieren, um eine erfolgreiche Schwann-Zell-Transplantation, ein langfristiges Überleben und möglicherweise eine Schwannombildung zu unterstützen. In diesem frühen Stadium der PDX-Modellentwicklung konzentrieren wir uns auf einen allgemeinen Machbarkeitsnachweis und werden daher allogene Spender und Empfänger verwenden (Maus zu Maus), die von einem einzigen Inzuchtmausstamm (C57Bl/6J) stammen, um die zusätzliche Komplexität immunogener Interaktionen/Transplantatabstoßungen auf ein späteres Entwicklungsstadium zu verschieben.
In unserem multifaktoriellen NF2-Mausmodell haben wir festgestellt, dass ein NF2-Mangel sowohl in Neuronen als auch in Schwann-Zellen wesentlich zur Bildung einer Nervenmikroumgebung beiträgt, die durch zusätzliche Signale wie z. B. mechanische Reizung tumorpermissiv wird. Daher werden alle Transplantationen im Kontext einer definierten operativen Nervenquetschung durchgeführt, welche in unserem etablierten Mausmodell ausreicht, um eine hochreproduzierbare Bildung von Schwannomen auszulösen. Darüber hinaus werden wir verschiedene Kombinationen von Spender- und Wirtsgenotypen mit NF2-Defizienz untersuchen, um Mindestanforderungen für eine erfolgreiche Transplantation und/oder Schwannombildung zu definieren. Die Spender-Schwann-Zellen werden vor der Transplantation gentechnisch so verändert, dass sie dauerhaft ein rot fluoreszierendes Protein exprimieren, so dass diese auch langfristig in den Empfängermäusen als Spenderzellen re-identifiziert werden können und transplantierte (exogene) von bereits vorhandenen (endogenen) Schwann-Zellen unterschieden werden können. Bei den Spenderzellen handelt es sich entweder um Wildtyp- oder NF2-defiziente (homozygote Nf2flox/flox;P0-Cre Schwann-Zellen aus unserem etablierten Mausmodell). Die Empfängermäuse sind entweder Wildtyp, NF2-defizient nur in Neuronen (Nf2flox/flox;Nefh-Cre) oder NF2-defizient sowohl in Neuronen als auch in Empfängerschwannzellen (Nf2flox/flox;Nefh-Cre;P0-Cre). Nach erfolgter operativer Nervenquetschung werden wir Spenderzellen direkt in den Ischiasnerv transplantieren, indem wir sie distal zu der Quetschung in den Nerv injizieren. Die Nerven werden vier Wochen nach Quetschung und Transplantation mittels einer etablierten Analysepipeline auf Schwannombildung untersucht. Dabei werden (A) die Größe des Nervs (Tumors) mittels Bildgebung und ImageJ-Makro-basierter Quantifizierung, (B) die Expression von Markergenen und -proteinen mittels Western Blot und RT-qPCR sowie (C) die Nervenzusammensetzung, die Physiologie und das Vorhandensein von transplantierten Spenderzellen (identifiziert durch die Expression des rot fluoreszierenden Proteins) in immunhistochemischen Färbungen bewertet.
Möglichweise können Wildtyp-Spenderschwannzellen in regenerierende Nerven integriert werden, aber wir erwarten nicht, dass diese Schwannome bilden, auch nicht in Nf2flox/flox;Nefh-Cre Mäusen. Demgegenüber erwarten wir, dass sich in unserem etablierten Empfängermausmodell Nf2flox/flox;Nefh-Cre;P0-Cre auf jeden Fall Schwannome bilden, auch wenn es eine offene Frage bleibt, wie die Transplantation von Wildtyp- bzw. NF2-defizienten Schwann-Zellen diesen Prozess beeinflusst. Von zentralem Interesse wird die Analyse von NF2-defizienten Schwann-Zellen sein, welche in Nf2flox/flox;Nefh-Cre Empfänger transplantiert werden. Hierbei soll die Frage geklärt werden, ob das Vorhandensein von NF2-defizienten Schwann-Zellen für die Schwannombildung lediglich erforderlich ist (d. h. endogene Wildtyp-Schwann-Zellen können dies kompensieren) oder aber in der Tat hinreichend ist (und nicht kompensiert / verdrängt werden kann), wenn die Mikroumgebung des Nervs aus NF2-depletierten neuronalen Zellen besteht. Insgesamt werden uns diese ersten Experimente Aufschluss über die generelle Machbarkeit sowie die ideale genetische Zusammensetzung des Empfänger-Mausmodells geben, welches für die weitere PDX-Entwicklung verwendet werden soll.
AP2 – Screening eines geeigneten immundefizienten Empfänger-Hintergrundstamms
MS 2.1 – Regeneration des Ischiasnervs bei immundefizienten Mäusen
Einerseits erfordert die Xenotransplantation menschlicher Zellen in Mäuse die Verwendung eines immundefizienten Mausstamms, um einer Abstoßung des Transplantats vorzubeugen. Andererseits haben unsere früheren Arbeiten gezeigt, dass Immunzellen, insbesondere Makrophagen, einen wesentlichen Beitrag zum Prozess der Nervenregeneration leisten, bzw. zu Beeinträchtigungen der Regeneration, welche zur Bildung von Schwannomen und altersbedingten Regenerationsdefiziten führen. In diesen Szenarien konnte die Behandlung mit Acetylsalicylsäure die Makrophageninfiltration reduzieren, die Nervenregeneration verbessern und die Schwannombildung verringern, was den potentiellen Nutzen einer entzündungshemmenden Behandlung in pathologischen Zuständen aufzeigt. Es ist jedoch nicht vollständig bekannt, wie sich die Verringerung der Immunreaktion in immundefizienten Mausmodellen auf die normale Nervenregeneration auswirkt.
Wir werden diesen Einfluss auf die Nervenregeneration in verschiedenen immundefizienten Mausmodellen testen, indem wir die Wiederherstellung der motorischen und sensorischen Funktionen über vier Wochen nach einer operativen Nervenquetschung nachverfolgen sowie eine histologische Endpunktanalyse zur weiteren Bewertung der Nervenphysiologie und -regeneration vornehmen. Wir werden sowohl das weit verbreitete SCID-Modell als auch zwei zusätzliche FLI interne Modelle untersuchen, welche von Claudia Waskow (Seniorgruppenleiterin Immunologie) vorgeschlagen und bereitgestellt wurden, um zu beurteilen, ob und in welchem Maße die Nervenregeneration in diesen drei Mausmodellen beeinträchtigt ist. Die drei immundefizienten Mausmodelle unterscheiden sich durch den Grad der Immundefizienz bzw. die Anzahl und Art der fehlenden Immunzellen, wobei nur SCID-Mäuse normale Mengen voll funktionsfähiger Makrophagen aufweisen (aber immer noch fehlende B- und T-Lymphozyten, wie die anderen beiden Modellen auch). Ein Vergleich des Regenerationserfolgs mit dem Wildtyp C57Bl/6J wird als Referenz durchgeführt, da dies der Hintergrundstamm unseres NF2-Mausmodells sowie von zwei der drei immundefizienten Modelle ist.
MS 2.2 – Xenotransplantation von primär-ähnlichen menschlichen NF2-defizienten Schwann-Zellen
Um die Eignung der verschiedenen immundefizienten Mausmodelle weiter zu bewerten, werden wir, analog zu den Arbeiten in AP1, eine Xenotransplantation von embryonal abgeleiteten, primär-ähnlichen (nicht immortalisierten) menschlichen Schwann-Zellen (Wildtyp sowie NF2-defizient) in operativ gequetschte Ischiasnerven von Mäusen durchführen. Wie in AP1 beschrieben werden die Spenderzellen zuvor so modifiziert, dass sie ein rot fluoreszierendes Protein exprimieren, um eine spätere Re-Identifikation und Unterscheidung von endogenen (murinen) Schwann-Zellen zu ermöglichen. Wir werden das Überleben und die Integration der menschlichen Schwann-Zellen in regenerierenden Mausnerven sowohl 4 Wochen nach Quetschung (wenn sich Schwannome normalerweise zu manifestieren beginnen) sowie 12 Wochen danach untersuchen, um auch das langfristige Überleben und die Entwicklung des Xenotransplantats zu untersuchen.
In früheren Arbeiten, bei denen ein homozygotes Mausmodell mit Knockout exklusiv in Schwann-Zellen (Nf2flox/flox;P0-Cre) verwendet wurde, führte eine Nervenquetschung zu einer signifikanten Schwellung – wenn auch einer, die histopathologisch nicht als Tumor eingestuft wurde. Experimentell besteht daher die Möglichkeit, dass eine Xenotransplantation von NF2-defizienten menschlichen Schwann-Zellen ebenfalls eine spürbare Nervenschwellung hervorrufen könnte. Wir werden diese Möglichkeit untersuchen, indem wir die Größe des Nervs im Vergleich zum unverletzten, nicht xenotransplantierten kontralateralen Nerv messen und die Ergebnisse mit den Ergebnissen von AP1 vergleichen, insbesondere mit denen der Allotransplantation von Wildtyp- oder NF2-defizienten murinen Schwann-Zellen auf Wildtyp-Empfängermäuse. Zusammengenommen werden uns diese Tests Aufschluss darüber geben, welcher Immundefekt die Xenotransplantation menschlicher Schwann-Zellen am besten unterstützt und zu „normalen“ Regenerationsreaktionen im Sinne unserer vorangegangenen Allotransplantationsstudien führt.
AP3 – Etablierung und Validierung des patienten-abgeleiteten Xenotransplantatmodells
MS 3.1 – Etablierung der PDX Spender-Schwannzellkultur
Die initiale Entwicklung (vgl. AP2 – Ziel 2.2) wird unter Verwendung einer embryonal abgeleiteten primär-ähnlichen menschlichen Schwann-Zelllinie aus kommerzieller Quelle (ScienCell Research Laboratories) durchgeführt, welche von der mit uns zusammenarbeitenden Gruppe von Christina Fernandez-Vallez (University of Central Florida, USA) validiert und charakterisiert wurde. Für das endgültige PDX-Mausmodell wollen wir hierauf aufbauen, um die Transplantation von primären NF2-Patientenschwannomzellen zu ermöglichen. Zu diesem Zweck werden wir frische Schwannom-Patientenproben beziehen, idealerweise von Steffen Rosahl (Helios Kliniken Erfurt, Vereinbarung steht noch aus).
Nach Erhalt des Patientenmaterials werden primäre Tumor-Schwann-Zellen durch Gewebehomogenisierung und FACS-Sortierung für den Oberflächenmarker CD271/p75/LNGFR isoliert, welcher ein spezifischer Marker für Vorläufer-, nicht-myelinisierende und Reparatur-Schwann-Zellen ist, wobei letztere die Ursprungszellen für die Schwannombildung darstellen, wie unsere früheren Arbeiten gezeigt haben. Mit diesem Ansatz (CD271-basierte FACS-Sortierung) haben wir bereits die Isolierung reiner primärer Schwann-Zellen aus der Maus etabliert, und wir beabsichtigen unsere Protokolle entsprechend anzupassen, um die auch Isolierung primärer menschlicher Tumor-Schwann-Zellen zu ermöglichen.
Zu den Faktoren, die getestet und für die Etablierung der vom Patienten stammenden Tumor-Schwann-Zelllinien angepasst/optimiert werden sollen, gehören z. B. der Zeitpunkt der Isolierung nach der chirurgischen Entfernung, Gewebeaufschlussprotokolle, Kultivierungsmedien und -oberflächen, Durchführbarkeit einer Kryokonservierung und -rekonstitution, Eignung für weitere genetische Modifikationen (Einführung eines rot fluoreszierenden Reporters durch lentivirale Transduktion, vgl. AP1 und AP2), usw. Ziel ist es, kryokonservierte Lagerbestände reiner Tumor-Schwann-Zellen mit fluoreszierendem Reporter für die Xenotransplantation sowie möglicherweise auch ohne Reporter für zusätzliche Arbeiten zur weiteren Charakterisierung der erhaltenen Zelllinien zu erzeugen.
MS 3.2 – Erzeugung von Nf2-defizienten, immundefizienten Empfängern
Die weitere Entwicklung des PDX-Modells wird stark von den Ergebnissen aus AP1 und AP2 abhängen, insbesondere von der Wahl des immundefizienten Hintergrundstamms. Um immundefiziente Empfängermäuse für das endgültige NF2-PDX-Modell zu erzeugen, müssen die erforderlichen NF2-Modell-bezogenen Transgene (Nf2flox/flox sowie Nefh-Cre entweder allein oder in Kombination mit P0-Cre, vgl. AP1) in den immundefizienten Hintergrundstamm der Wahl (vgl. AP2) eingekreuzt werden, welcher selbst jeweils aus ein bis drei Transgenen besteht. Insgesamt erfordert dies eine sorgfältige Planung der erforderlichen Zuchtstrategie sowie einen Zeitaufwand, der je nach dem genauen Hintergrundstamm und der gewünschten Genzusammensetzung zwischen 6 Monaten und 2 Jahren liegen kann. Daher fallen die folgenden Arbeiten, die als MS 3.2 und MS 3.3 vorgestellt werden, nicht in den Rahmen des aktuellen Finanzierungsvorschlags, sondern werden zu einem späteren Zeitpunkt separat beantragt, sobald die Einzelheiten und die Voraussetzungen in AP1 und AP2 ermittelt worden sind. Ziel 3.2 wird daher nicht weiter beschrieben, da es vor allem die Züchtung der immundefizienten NF2-defizienten Empfängermäuse umfasst, welche noch detailliert werden muss.
MS 3.3 – PDX Etablierung und Validierung
Im Gegensatz hierzu wird MS 3.3 wahrscheinlich weitgehend unverändert bleiben, unabhängig von den endgültigen Details der in MS 3.2 erzeugten Empfängermäuse, wobei jedoch davon ausgegangen wird, dass eine geeignete Empfängermaus erfolgreich definiert und erzeugt werden konnte. Im Folgenden wird eine Beschreibung von MS 3.3 gegeben, um die Perspektiven der weiteren PDX-Entwicklung zu skizzieren (diese Beschreibung ist zum jetzigen Zeitpunkt rein informativ und unterliegt potenziell Änderungen, eine Anschlussfinanzierung wird zu einem späteren Zeitpunkt separat beantragt).
Nach der erfolgreichen Etablierung geeigneter PDX-Empfängermäuse (vgl. MS 3.2) und der Generierung von Schwannomzellkulturen von Patienten (vgl. MS 3.1) werden wir diese Arbeitsergebnisse kombinieren, um unser neues NF2-PDX-Mausmodell zu etablieren und zu validieren. Zu diesem Zweck werden Empfängermäuse einer operativen einseitigen Ischiasnervenquetschung unterzogen und anschließend Spenderzellen direkt in den Ischiasnerv injiziert, distal der Verletzungsstelle. Zum Vergleich werden wir parallel (in unabhängigen Empfängern) sowohl von Patienten gewonnene als auch kommerziell embryonal-abstammende (vgl. MS 3.1) NF2-defiziente Schwann-Zellen xenotransplantieren. Anschließend werden die Mäuse beginnend einen Tag nach operativer Nervenquetschung und Xenotransplantation für sechs Wochen entweder mit Brigatinib (50 mg/kg einmal täglich), Bentamapimod (30 mg/kg zweimal täglich) oder einer Vehikelkontrolle behandelt, um das neuartige PDX-Modell anhand von klinisch etablierten Goldstandards zu validieren. Der Erfolg der Etablierung des PDX-Modells wird anhand der quantifizierbaren Schwannom-Induktion bei Tieren, die mit der Vehikelkontrolle behandelt wurden, sowie deren Rückgang bei Brigatinib- bzw. Bentamapimod-behandelten Tieren bewertet. Mit Hilfe einer etablierten Analyse-Pipeline soll das etablierte PDX-Mausmodell weiter charakterisiert und seine Eignung als klinisch relevante Screening-Plattform für neue Wirkstoffkandidaten und alternative therapeutische Ansätze untersucht werden.
Ziel 3.3. wird gemäß unserem etablierten präklinischen Studienrahmenwerk in Anlehnung an humanklinische Studienstandards (adaptiert zu einem monozentrischen Design) durchgeführt, um ein Höchstmaß an Robustheit und Übertragbarkeit der Studie zu gewährleisten. Konkret wird MS 3.3 im Tierversuchsregister des Deutschen Zentrums für Schutz von Versuchstieren (Bf3R) detailliert registriert, wir verwenden Randomisierung und Verblindung bei der Durchführung der Behandlung sowie bis hin zur statistischen Auswertung, dediziertes Studienmonitoring und Datenmanagement sowie eine kontinuierliche Dokumentation in einer REDCap-Datenbankinfrastruktur.
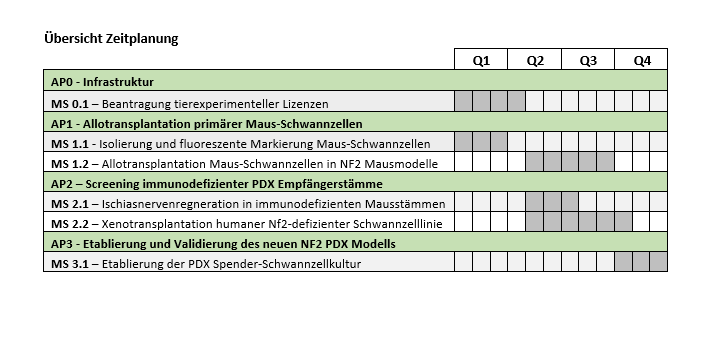
Übersicht Zeitplanung
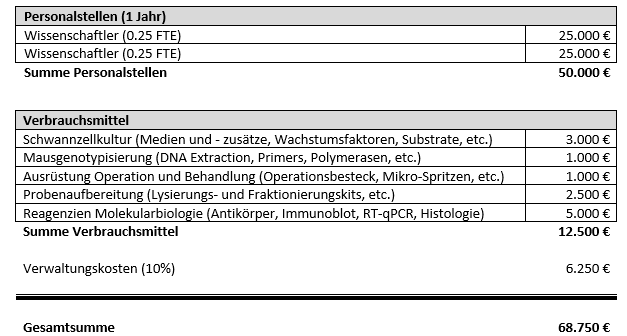
Budgetplanung
Die vorgeschlagenen Arbeiten werden in unser etabliertes präklinisches Studienframework integriert. Wir werden die wissenschaftliche Infrastruktur und Expertise für dieses Projekt einschließlich eines dedizierten Projekt-(Meta-)Datenmanagementsystems, eines unabhängigen Studienmonitorings sowie Randomisierungs- und Verblindungsmaßnahmen (welche von einem zusätzlichen gruppeninternen präklinischen Studienmonitor durchgeführt werden, dessen Finanzierung in diesem Antrag nicht beantragt wird) zur Verfügung stellen.
Um die vorgeschlagenen Arbeiten effizient und zeitnah durchführen zu können, ist es außerdem erforderlich, dass zwei erfahrene Wissenschaftler als Team zusammenarbeiten, insbesondere bei den Operationen und der Behandlung der Tiere. In der verbleibenden Zeit werden die Aufgaben je nach Bedarf innerhalb des Teams verteilt, um den Projektfortschritt zu beschleunigen.